![O bioquímico dinamarquês Peter Lauritz Sorensen (1868-1939) propôs o uso de uma escala logarítmica para trabalhar com as concentrações do íon hidrônio [H3O+(aq)] nas soluções, que ele chamou de pH.](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgJ9mm29VVyv5GDMnzWKhssp6HEwjETcuEJHq-kZ1irJRSFvb7DLU4OoKdjbNppyW14ccQJAwxdkZeTyz2RVvQeKaCVIOyST7jx8P0p8qMAw8_sVZ6QCGpyl28g9Uam9JMqa0sTfHJrpE0/w280-h320-rw/PH+e+cerveja.png) |
Pouca gente sabe que o parâmetro chamado de pH ( potencial hidrogeniônico) foi idealizado pelo químico dinamarquês Peter Sörensen(1868-1039) para a melhoria da qualidade de um produto que até hoje faz muito sucesso no meio social, a cerveja! Isso mesmo, cerveja! Tudo começou por causa dela.
O doutor em química inorgânica pela Universidade Técnica de Copenhagen, Søren Peter Lauritz Sørensen foi convidado a dirigir o Laboratório Carlsberg no ano de 1900, que era associado à cervejaria Carlsberg. Neste laboratório, começou a realizar diversas experiências bioquímicas relacionadas com aminoácidos, proteínas e enzimas, com o objetivo de facilitar seus trabalhos no controle de qualidade de cervejas. Foi então que no meio dessas experiências, desenvolveu um método para medir a acidez ou níveis de alcalinidade das cervejas, o qual deu o nome de pH.
O valor do pH está diretamente relacionado com a quantidade de íons hidrogênio de uma solução, as substâncias que revelam a presença de íons livres em uma solução são conhecidas como indicadores, esses mudam de cor em função da concentração de H+ e de OH- de uma solução, ou seja, do pH.
Sabemos que o pH se tornou uma parâmetro para qualidade de muitos produtos, como sabonetes, shampoos, azeites e soluções diversas. O nosso sangue, a água do mar, e até o refrigerante que bebemos tem pH.
Mas antes devo explicar que a escala de pH criada por Sorensen, vai de 0 a 14, pois se baseia na autoionização da água pura. Os cálculos logarítimicos das quantidades em Mol do números de moléculas ionizadas dão um Kw=10 elevado a -14mol/L.

Segundo os Estudos de Sörensen, a ação enzimática sobre o substrato da cerveja ocorre num pH de cerca de 4,5, ou seja pH um pouco ácido. Isso depende da temperatura é claro.
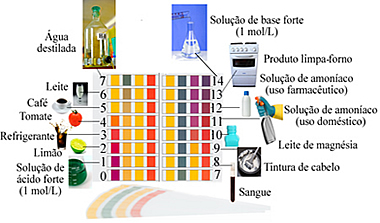
Escala de pH com exemplos de soluções com pH próximo ao indicado
Esses valores podem ser medidos de forma precisa por meio de um aparelho chamado peagômetro, como o mostrado abaixo:

Peagômetro usado para medir o pH de soluções
Muitas vezes, em laboratórios, para determinar o pH de soluções de um modo não tão preciso, utilizam-se indicadores ácido -bases. Esses são substâncias naturais ou sintéticas que mudam de cor na presença de soluções ácidas e básicas e em diferentes faixas de pH. Entre os indicadores sintéticos mais usados está a fenolftaleína, que é incolor em meio ácido e bem rosa em meio básico; o papel de tornassol, que fica vermelho na presença de ácidos e azul na presença de bases; e o indicador universal, que apresenta cores diferentes para cada valor de pH, sendo bastante preciso:
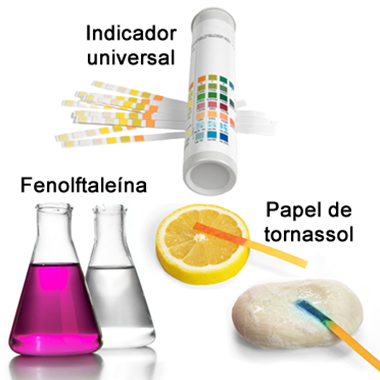
Exemplos de indicadores ácido-base sintéticos: tiras de indicador universal, fenolftaleína e papel de tornassol
Entre os indicadores naturais, temos as soluções extraídas de muitos vegetais, tais como das folhas de repolho roxo, beterraba, uvas, jabuticabas, amoras, bem como em folhas vermelhas e flores de pétalas coloridas, como as flores de azaleia e quaresmeira.
O doutor em química inorgânica pela Universidade Técnica de Copenhagen, Søren Peter Lauritz Sørensen foi convidado a dirigir o Laboratório Carlsberg no ano de 1900, que era associado à cervejaria Carlsberg. Neste laboratório, começou a realizar diversas experiências bioquímicas relacionadas com aminoácidos, proteínas e enzimas, com o objetivo de facilitar seus trabalhos no controle de qualidade de cervejas. Foi então que no meio dessas experiências, desenvolveu um método para medir a acidez ou níveis de alcalinidade das cervejas, o qual deu o nome de pH.
O valor do pH está diretamente relacionado com a quantidade de íons hidrogênio de uma solução, as substâncias que revelam a presença de íons livres em uma solução são conhecidas como indicadores, esses mudam de cor em função da concentração de H+ e de OH- de uma solução, ou seja, do pH.
Sabemos que o pH se tornou uma parâmetro para qualidade de muitos produtos, como sabonetes, shampoos, azeites e soluções diversas. O nosso sangue, a água do mar, e até o refrigerante que bebemos tem pH.
Mas antes devo explicar que a escala de pH criada por Sorensen, vai de 0 a 14, pois se baseia na autoionização da água pura. Os cálculos logarítimicos das quantidades em Mol do números de moléculas ionizadas dão um Kw=10 elevado a -14mol/L.

Segundo os Estudos de Sörensen, a ação enzimática sobre o substrato da cerveja ocorre num pH de cerca de 4,5, ou seja pH um pouco ácido. Isso depende da temperatura é claro.
CONCEITO DE PH
Explicando o de pHO pH é definido como potencial hidrogeniônico, que é uma escala logarítmica que indica com valores de 0 a 14 se a solução é ácida, neutra ou básica.
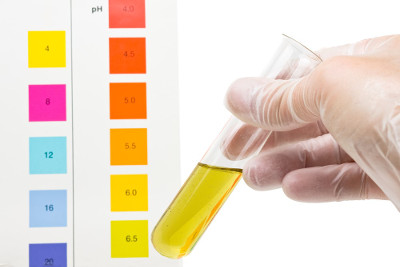 Técnico de laboratório verifica o pH de uma solução colocando uma tira de indicador universal nela e comparando com a escala Texto:
Técnico de laboratório verifica o pH de uma solução colocando uma tira de indicador universal nela e comparando com a escala Texto:
A+
A-
Segundo a Teoria da dissociação iônica de Arrhenius, uma substância é considerada ácida se, em meio aquoso, ela liberar como único cátion o H+ (ou H3O+). Quanto maior a quantidade desses íons no meio, maior será a acidez da solução.
O pH é a sigla usada para potencial (ou potência) hidrogeniônico, porque se refere à concentração de [H+] (ou de H3O+) em uma solução. Assim, o pH serve para nos indicar se uma solução é ácida, neutra ou básica.
A escala de pH varia entre 0 e 14 na temperatura de 25ºC. Se o valor do pH for igual a 7 (pH da água), o meio da solução (ou do líquido) será neutro. Mas se o pH for menor que 7, será ácido, e se for maior que 7, básico.

Valores de pH para soluções ácidas, neutras e básicas
Observe que quanto menor o valor do pH, mais ácida a solução será. Isso acontece porque, conforme já mencionado, essa escala é logarítmica, o que quer dizer que o pH é definido como logaritmo negativo da concentração dos íons [H+(aq)] na base 10:
colog [H+] = - log [H+]
pH = - log [H+]
[H+] = 10-pH, em mol/L
Isso significa que, por exemplo, se temos duas soluções a 25ºC com volumes iguais, sendo que a primeira tem pH igual a 4 e a segunda tem pH igual a 3, então a segunda solução possui 10 vezes mais íons H+ que a primeira.
Veja abaixo os valores de pH para algumas substâncias do nosso cotidiano:
Explicando o de pHO pH é definido como potencial hidrogeniônico, que é uma escala logarítmica que indica com valores de 0 a 14 se a solução é ácida, neutra ou básica.
 Técnico de laboratório verifica o pH de uma solução colocando uma tira de indicador universal nela e comparando com a escala Texto:
Técnico de laboratório verifica o pH de uma solução colocando uma tira de indicador universal nela e comparando com a escala Texto:A+
A-
Segundo a Teoria da dissociação iônica de Arrhenius, uma substância é considerada ácida se, em meio aquoso, ela liberar como único cátion o H+ (ou H3O+). Quanto maior a quantidade desses íons no meio, maior será a acidez da solução.
O pH é a sigla usada para potencial (ou potência) hidrogeniônico, porque se refere à concentração de [H+] (ou de H3O+) em uma solução. Assim, o pH serve para nos indicar se uma solução é ácida, neutra ou básica.
A escala de pH varia entre 0 e 14 na temperatura de 25ºC. Se o valor do pH for igual a 7 (pH da água), o meio da solução (ou do líquido) será neutro. Mas se o pH for menor que 7, será ácido, e se for maior que 7, básico.

Valores de pH para soluções ácidas, neutras e básicas
Observe que quanto menor o valor do pH, mais ácida a solução será. Isso acontece porque, conforme já mencionado, essa escala é logarítmica, o que quer dizer que o pH é definido como logaritmo negativo da concentração dos íons [H+(aq)] na base 10:
colog [H+] = - log [H+]
pH = - log [H+]
[H+] = 10-pH, em mol/L
Isso significa que, por exemplo, se temos duas soluções a 25ºC com volumes iguais, sendo que a primeira tem pH igual a 4 e a segunda tem pH igual a 3, então a segunda solução possui 10 vezes mais íons H+ que a primeira.
Veja abaixo os valores de pH para algumas substâncias do nosso cotidiano:

Escala de pH com exemplos de soluções com pH próximo ao indicado
Esses valores podem ser medidos de forma precisa por meio de um aparelho chamado peagômetro, como o mostrado abaixo:

Peagômetro usado para medir o pH de soluções
Muitas vezes, em laboratórios, para determinar o pH de soluções de um modo não tão preciso, utilizam-se indicadores ácido -bases. Esses são substâncias naturais ou sintéticas que mudam de cor na presença de soluções ácidas e básicas e em diferentes faixas de pH. Entre os indicadores sintéticos mais usados está a fenolftaleína, que é incolor em meio ácido e bem rosa em meio básico; o papel de tornassol, que fica vermelho na presença de ácidos e azul na presença de bases; e o indicador universal, que apresenta cores diferentes para cada valor de pH, sendo bastante preciso:

Exemplos de indicadores ácido-base sintéticos: tiras de indicador universal, fenolftaleína e papel de tornassol
Entre os indicadores naturais, temos as soluções extraídas de muitos vegetais, tais como das folhas de repolho roxo, beterraba, uvas, jabuticabas, amoras, bem como em folhas vermelhas e flores de pétalas coloridas, como as flores de azaleia e quaresmeira.
Por Ed Ferreira/photossintese

Nenhum comentário:
Postar um comentário